Une nouvelle alerte a été lancée sur les risques des respirateur d’interférence.
Ceux-ci présentent un risque d’interférence avec des dispositifs médicaux implantés métalliques.
Le groupe néerlandais avait déjà rappelé massivement des respirateurs défectueux en juin 2021.
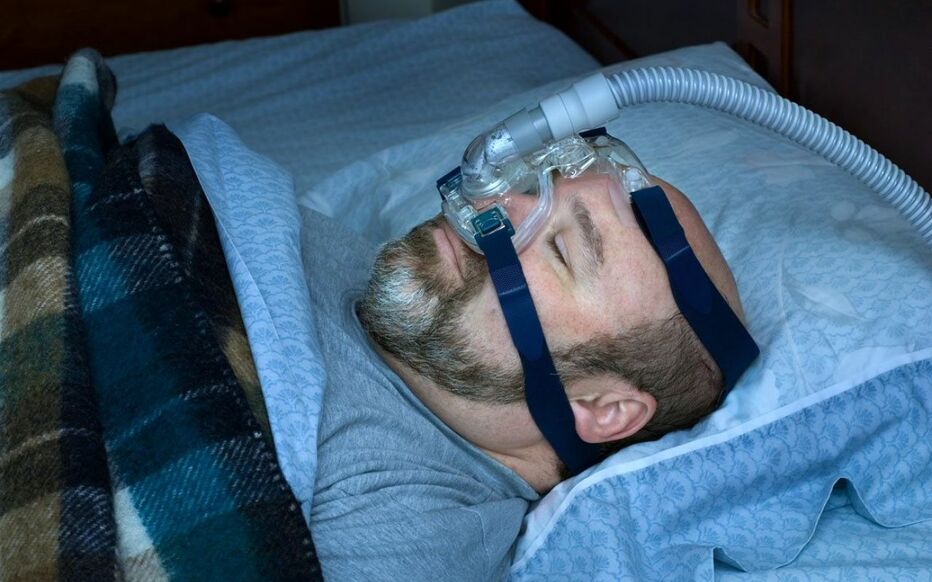
Nouvelle alerte autour des Respirateurs Philips. Les masques avec aimants du fabricant, pour les appareils respiratoires contre l’apnée du sommeil, présentent un risque d’interférence avec des dispositifs médicaux implantés métalliques, comme des stimulateurs cardiaques, a signalé le groupe néerlandais, rapporte l’Agence nationale de la sécurité du médicament (ANSM) ce mercredi 2 novembre.
Des interférences pourraient survenir « lorsque les patients ou l’un des membres de leur foyer portent des dispositifs implantés métalliques et sont susceptibles de se trouver à proximité de ces masques contenant des aimants (à une distance inférieure à 15 cm) » et « entraîner un dysfonctionnement » des implants, selon un communiqué de l’ANSM. Quatorze cas ont été signalés dans le monde, majoritairement aux États-Unis, précise l’agence. En France, un cas a été rapporté par le fabricant le 19 septembre, « sans conséquence pour le patient », ajoute-t-elle.
Une campagne massive mondiale de rappel en juin 2021 sur des Respirateurs Philips:
Cinq modèles de masques sont concernés : le masque facial Amara View à contact minimal, le masque facial DreamWear, masque nasal DreamWisp avec coussin sur le nez, les masques nasaux Wisp et Wisp Youth et le masque de traitement 3100 NC/SP. Une large palette d’implants médicaux métalliques est susceptible de subir des interférences : pacemakers ; implants/électrodes/valves métalliques et magnétiques dans les membres supérieurs, le torse, le cou, la tête ; stents métalliques (par exemple anévrisme, coronaire, trachéo-bronchique, biliaire) ; implants oculaires ; ports et pompes implantables (par exemple pompes à insuline)…
Meurtre de Lola : les motivations de Dahbia B
Les patients utilisant ces masques et portant – eux, ou quelqu’un de leur entourage – un dispositif médical métallique implanté doivent contacter leur médecin pour prendre conseil et leur prestataire de santé à domicile pour les faire remplacer par d’autres sans aimant, indique l’ANSM.
En juin 2021, une campagne de rappel massive à travers le monde pour des Respirateurs Philips défectueux pour l’apnée du sommeil. En cause : la mousse insonorisante contenue dans certains des appareils du fabricant, utilisés par quelque 350.000 patients en France et 1,5 million dans toute l’Europe, contenait des particules potentiellement dangereuses pour l’utilisateur si elles étaient inhalées ou ingérées (le groupe avait aussi évoqué en juin 2021 un risque « potentiel » de cancer à long terme). Depuis, Philips tarde à remplacer les appareils défectueux.
Le parquet de Paris s’est saisi depuis juin de plusieurs plaintes pour tromperie aggravée et mise en danger de la vie d’autrui déposées par des patients dénonçant les appareils respiratoires . Le groupe néerlandais a annoncé, la semaine dernière, un creusement de ses pertes au troisième trimestre, principalement par une importante charge pour le rappel des appareils défectueux et annoncé la suppression d’environ 4000 postes.
Respirateurs Philips défectueux : un problème connu dès 2016 ?
Des appareils utilisés par des patients souffrant d’apnée du sommeil.
Depuis juin 2021, le groupe a engagé une campagne massive de rappel de plusieurs modèles Respirateurs Philips défectueux de respirateurs utilisés notamment par des patients souffrant d’apnée du sommeil. Ces appareils, utilisés par environ 370.000 patients en France et quelque 1,5 million dans toute l’Europe, contiennent une mousse insonorisante. C’est celle-ci qui est en cause : le groupe a remarqué que des particules sortaient de certains appareils et pouvaient donc être inhalées ou ingérées par le patient. Cela peut provoquer des irritations, comme des maux de tête. Le groupe avait aussi évoqué en juin 2021 un risque « potentiel » de cancers à long terme.
Selon les documents transmis par ce collectif d’avocats français, américains, italiens et autrichiens, le groupe Philips et une partie de ses sous-traitants américains ont eu connaissance du problème lié cette fameuse mousse en polyuréthane bien avant de procéder au rappel des produits, et surtout sans en informer ni les utilisateurs ni les autorités sanitaires concernées. Des échanges de mails entre des représentants de Philips et l’un de ses sous-traitants évoquent ainsi des dégradations suspectes dès 2016. Ils montrent, en outre, que le groupe utilisait une mousse contenant un retardateur de flamme, et qu’elle n’était pas adaptée pour un usage médical.